Zellkultur-Kontamination
5 häufige Ursachen und wie Sie sie vermeiden
Kontaminationen gehören zu den häufigsten und frustrierendsten Herausforderungen in der Zellkultur. Ob in der akademischen Forschung oder der biotechnologischen Produktion – ein einzelner Kontaminationsfall kann monatelange Arbeit zunichtemachen.
In diesem Artikel beleuchten wir die 5 häufigsten Ursachen für Kontaminationen in der Zellkultur und geben praktische, umsetzbare Tipps zur Vorbeugung – damit Sie die Integrität und Reproduzierbarkeit Ihrer Ergebnisse sicherstellen können.
Fachlich geprüft von Dr. Sabrina Friederichs · Zuletzt aktualisiert am 18. Juni 2025
TL;DR: Zusammenfassung
So vermeiden Sie Kontaminationen in der Zellkultur
Nur 30 Sekunden Zeit? Das ist das Wichtigste:
- Verwenden Sie konsequent aseptische Techniken – bei jedem einzelnen Arbeitsschritt
- Verlassen Sie sich nicht auf Antibiotika – sie verdecken mehr, als sie helfen
- Testen Sie regelmäßig auf Kontaminationen, insbesondere auf Mykoplasmen
- Arbeiten Sie immer nur mit einer Zelllinie gleichzeitig und beschriften Sie alles eindeutig
- Halten Sie Inkubatoren und Arbeitsbereiche sauber und gut gewartet
- Verwenden Sie zertifizierte, kontaminationsfreie Reagenzien
- Quarantänisieren und überprüfen Sie neue Zelllinien vor der Verwendung
Kostenlose Checkliste zum Ausdrucken: Halten Sie Ihre Kulturen sauber
Laden Sie unsere Checkliste zur Kontaminationsvermeidung herunter und hängen Sie sie direkt an Ihre Werkbank!
- ✅ Tägliche Erinnerungen für den Umgang
- 🧪 Wöchentliche und monatliche Wartungsprotokolle
- 🔬 Wichtige Kontrollpunkte für Mykoplasmen, Kreuzkontaminationen & mehr
📋 Überblick über Kontaminationsrisiken in der Zellkultur
Direkt zu einem Abschnitt springen:
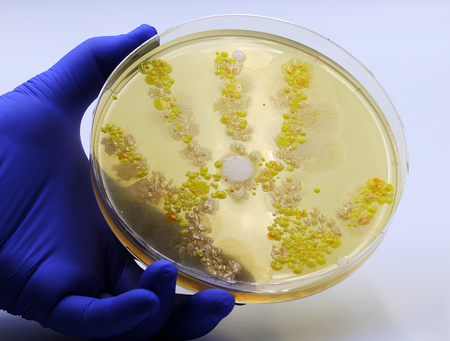
1. Bakterielle Kontamination
Eine unsichtbare Gefahr mit sichtbaren Folgen
Bakterien gehören zu den häufigsten und am schnellsten zerstörerischen Kontaminationsquellen in der Zellkultur.
Sie gelangen durch unsaubere Oberflächen, kontaminierte Reagenzien oder mangelhafte aseptische Technik in die Kultur – mit oft schnellen und deutlich sichtbaren Auswirkungen.
🔍 So erkennen Sie bakterielle Kontamination
- Trübes oder milchiges Kulturmedium
- Plötzlicher pH-Abfall oder -Schwankungen (z. B. Medium wird gelb)
- Unangenehmer oder säuerlicher Geruch
- Ungewöhnliche Zellmorphologie oder verlangsamtes Wachstum
- Kleine (∼1–5 µm), bewegliche Partikel unter dem Mikroskop sichtbar
✅ So vermeiden Sie bakterielle Kontamination
- Arbeiten Sie immer unter einer korrekt gewarteten Laminar-Flow-Werkbank
- Verwenden Sie sterile Pipettenspitzen, Flaschen und Reagenzien
- Desinfizieren Sie Arbeitsflächen vor und nach jeder Sitzung (z. B. mit 70 % Ethanol)
- Setzen Sie Antibiotika nur gezielt ein, um niedrige Kontaminationsniveaus nicht zu überdecken oder Resistenzen zu fördern
- Lagern Sie Reagenzien korrekt und kontrollieren Sie regelmäßig das Verfallsdatum
💡 Das Risiko verstehen
So breiten sich Bakterien aus
Bakterielle Kontamination kann schnell eine gesamte Zellkulturreihe gefährden. Meist erfolgt die Einschleppung durch unsachgemäßen Umgang, unzureichende Reinigung oder bereits kontaminierte Reagenzien. Einmal im System, vermehren sich die Bakterien rasant, verdrängen die Zellen und verändern deren Umgebung – oft ohne Chance auf Rettung.
Warum Vorbeugung entscheidend ist
Auch wenn visuelle Anzeichen wie Trübung die Erkennung erleichtern, ist Vorbeugung deutlich effektiver als Schadensbegrenzung. Viele Labore setzen Antibiotika als Schutzmaßnahme ein – was jedoch ein trügerisches Sicherheitsgefühl vermitteln kann. Stattdessen bilden konsequente aseptische Arbeitsweise, Sauberkeit im Umfeld und sorgfältiger Umgang mit Reagenzien die Grundlage für den Schutz vor bakterieller Kontamination.
2. Mykoplasmen-Kontamination in der Zellkultur
Die unsichtbare Gefahr
Durch ihre kleine Größe (~0,3 µm) und das Fehlen einer Zellwand stellen Mycoplasma-Arten eine ernsthafte Bedrohung in der Zellkultur dar – und bleiben häufig unentdeckt.
🔍 So erkennen Sie eine Mykoplasmen-Kontamination
- Keine sichtbaren Veränderungen im Medium (keine Trübung oder Geruch)
- Unerklärliche Veränderungen in Wachstumsrate oder Zellmorphologie
- Reduzierte Transfektionseffizienz
- Nachweis durch spezifische Tests:
- PCR (hohe Sensitivität, Protokoll auf PubMed)
- Fluoreszenzfärbung
- ELISA oder DNA-bindende Farbstoffe
✅ So vermeiden Sie eine Mykoplasmen-Kontamination
- Verwenden Sie nur zertifiziert mykoplasmenfreie Zelllinien und Reagenzien
- Testen Sie alle neuen Zelllinien vor der Verwendung und lagern Sie sie unter Quarantäne-Bedingungen
- Führen Sie regelmäßige Mykoplasmen-Screenings durch (z. B. alle 1–2 Monate)
- Kaufen Sie FBS und Supplements bei zuverlässigen, getesteten Anbietern
- Vermeiden Sie die gemeinsame Nutzung von Medien oder Geräten zwischen verschiedenen Zelllinien
- Halten Sie eine strikte aseptische Technik ein und schulen Sie Ihr Team regelmäßig
💡 Warum Mykoplasmen so gefährlich sind
Warum sie schwer zu erkennen sind
Im Gegensatz zu anderen Bakterien oder Pilzen verursachen Mykoplasmen keine sichtbare Trübung und produzieren keinen Geruch. Sie entgehen so der routinemäßigen Sichtkontrolle und gehören zu den tückischsten Kontaminanten in der Zellkultur. Da sie keine Zellwand besitzen, sind sie resistent gegen viele Standardantibiotika und passieren typische Filterbarrieren.
Warum sie so schädlich sind
Der eigentliche Schaden liegt in ihrer subtilen Wirkung: Sie verändern die DNA, hemmen die Zellteilung oder beeinflussen die Zytokinproduktion – oft unbemerkt, bis experimentelle Daten inkonsistent oder nicht reproduzierbar sind. Ist eine Kontamination erst einmal bestätigt, ist ihre vollständige Entfernung ohne Verlust der Zelllinie extrem schwierig.
Deshalb sind Vorbeugung und Früherkennung unverzichtbar. Regelmäßige Tests, strenge Auswahlkriterien und präzise Technik sind Ihre besten Werkzeuge gegen diese unsichtbare Bedrohung.
👉 Sie möchten mehr über Mykoplasmen-Kontamination erfahren?
Lesen Sie unseren ausführlichen Artikel:
Mykoplasmen-Kontamination – Was Sie wissen sollten
Erfahren Sie alles über Nachweisverfahren, Quellen und Strategien zur Beseitigung – ideal bei Verdachtsfällen oder zur langfristigen Prävention.
3. Fadenpilze und Hefen
Luftgetragene Bedrohung für Zellkulturen
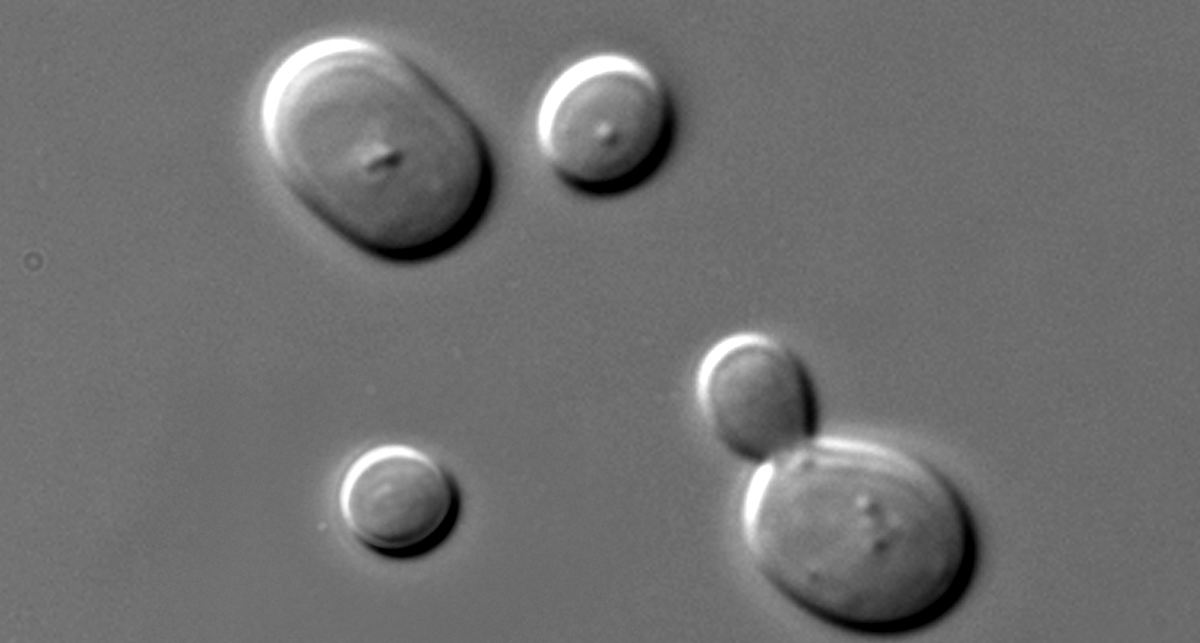
Fadenpilze und Hefen wachsen langsamer als Bakterien, aber immer noch deutlich schneller als Zellkulturen und sind daher hartnäckige und aggressive Kontaminanten. Sie gelangen meist über Sporen in der Luft, schlecht gewartete Geräte oder kontaminierte Reagenzien in die Kulturen. Im Gegensatz zu bakteriellen Kontaminationen dauert es oft länger, bis ein Pilzbefall auffällt – doch ist er erst einmal etabliert, lässt er sich nur schwer wieder beseitigen.
🔍 So erkennen Sie Pilz-/Hefekontamination
- Fadenartige Strukturen oder "flauschige" Gebilde im Medium
- Sichtbare Kolonien (weiß, grün oder dunkel) auf Flaschen oder Petrischalen
- Veränderung der Medium-Klarheit oder der Oberflächenspannung
- Gäriger Geruch der Zellkultur
- Hyphen oder Knospungszellen (~10 µm) im Mikroskop sichtbar
✅ So vermeiden Sie Pilz-/Hefekontamination
- Sorgen Sie für eine funktionierende Luftfiltration (HEPA-Filter) in Zellkulturräumen und Werkbänken
- Desinfizieren Sie CO₂-Inkubatoren wöchentlich – inklusive Regalen, Türdichtungen und Wasserwannen
- Überwachen und regulieren Sie die Luftfeuchtigkeit, insbesondere bei warmem Klima
- Führen Sie regelmäßige mikroskopische Kulturkontrollen durch
- Öffnen Sie Flaschen und Gefäße nur unter Laminar-Flow-Bedingungen
- Tauschen Sie kontaminierte Wasserwannen sofort aus – eine oft übersehene Quelle
💡 Warum Vorbeugung entscheidend ist
Pilzsporen lauern überall
Fadenpilze und Hefen bleiben oft unbemerkt, bis sie Oberflächen besiedeln oder die Zellviabilität beeinträchtigen. Im Gegensatz zu Bakterien bilden sie Sporen, die auf Oberflächen oder in der Luft lange überdauern – das macht sie besonders widerstandsfähig. Schon eine leicht kontaminierte Wasserwanne, ein Luftbefeuchter oder Laborkittel kann ausreichen, um die gesamte Kulturumgebung zu gefährden.
Wachsamkeit statt Nachsorge
Die Kontrolle von Luftfeuchtigkeit und Luftqualität ist eine grundlegende Verteidigungslinie. Wirklich entscheidend ist jedoch die Sorgfalt im Alltag – also das regelmäßige Inspizieren der Kulturen und Reinigen von Oberflächen. Sobald eine Pilzkolonie sichtbar ist, bleibt oft nur die vollständige Sterilisation und Entsorgung der betroffenen Kulturen als sichere Maßnahme.
4. Kreuzkontamination
Ein unterschätztes Risiko
Kreuzkontamination verläuft oft unbemerkt – kann Ihre Zellkulturarbeit jedoch dauerhaft beeinträchtigen.
Sie entsteht, wenn Zellen einer Linie unbeabsichtigt in eine andere eindringen – meist durch kleine Fehler beim Handling oder durch unklare Laborroutinen. Da Kreuzkontaminationen nicht sofort sichtbar sind, bleiben sie häufig unentdeckt, bis Inkonsistenzen in den Versuchsdaten auftreten.
🔍 So erkennen Sie Kreuzkontamination
- Unerwartete Veränderungen im Zellverhalten oder in der Morphologie
- Inkonsistente Versuchsergebnisse über Passagen hinweg
- Fehlende Authentizität der Zelllinie, nachgewiesen durch:
- STR-Profiling (Short Tandem Repeat-Analyse, Artikel in Nature)
- DNA-Barcoding oder Isoenzymanalysen
✅ So vermeiden Sie Kreuzkontamination
- Arbeiten Sie immer nur mit einer Zelllinie gleichzeitig
- Verwenden Sie eigene Pipetten, Medien und Reagenzien pro Zelllinie
- Beschriften Sie alle Gefäße klar und konsistent (Zelllinie, Datum, Passage)
- Führen Sie regelmäßige Authentifizierung der Zelllinien durch (z. B. alle 6–12 Monate)
- Setzen Sie SOPs für Zellkulturhandling und Beschriftung um und halten Sie sie ein
- Vermeiden Sie Multitasking – konzentrieren Sie sich auf eine Aufgabe zurzeit
💡 Warum dieses Risiko oft übersehen wird
Es sieht nicht wie eine Kontamination aus
Im Gegensatz zu mikrobieller Kontamination trübt Kreuzkontamination das Medium nicht und erzeugt keinen Geruch – stattdessen unterwandert sie still und leise Ihre Forschung. Eine schnell wachsende Zelllinie kann eine langsamere verdrängen, was zu Überwucherung, verändertem Phänotyp und verfälschten Daten führt.
Häufig durch Zeitdruck verursacht
Ob im akademischen oder industriellen Labor – Kreuzkontamination entsteht oft durch Zeitmangel oder Multitasking. Das schnelle Wechseln zwischen Zelllinien, die gemeinsame Nutzung von Reagenzien oder Pipetten oder das versehentliche falsche Beschriften einer Flasche reichen schon aus, um fremde Zellen in eine vermeintlich reine Kultur einzubringen.
Regelmäßige Authentifizierung ist nicht nur für Publikationen wichtig – sie ist aktive Prävention. In Kombination mit klaren Abläufen stellt sie sicher, dass Ihre „HeLa“-Zelllinie wirklich noch HeLa ist... und nicht etwas völlig anderes.
Erhalten Sie Expertentipps, neue Protokolle & Tools zur Prävention direkt in Ihr Postfach.
Jetzt zum Newsletter anmelden
5. Virale Kontamination
Ein Risiko für Forschung und Produktion
Viren zählen zu den schwerwiegendsten und am schwierigsten zu kontrollierenden Kontaminanten in der Zellkultur.
Sie können Kulturen unbemerkt infizieren, über längere Zeit latent bleiben und stellen sowohl in der akademischen Forschung als auch in der industriellen Anwendung ein erhebliches Sicherheitsrisiko dar. Besonders in der biopharmazeutischen Produktion kann eine virale Kontamination zu Projektabbrüchen, Produktrückrufen und regulatorischen Folgen führen (Artikel in Nature).
🔍 So erkennen Sie virale Kontamination
- Keine sichtbaren Anzeichen – latente Viren verändern das Medium oft nicht
- Unerklärliche zytopathische Effekte (Zellablösung, Rundung, Synzytienbildung)
- Verminderte Produktivität in Bioprozessen (z. B. geringere Proteinerträge)
- Nachweis durch:
- qPCR oder RT-PCR
- Immunfluoreszenz oder ELISA
- Elektronenmikroskopie in fortgeschrittenen Fällen
✅ So vermeiden Sie virale Kontamination
- Verwenden Sie virusgetestetes Serum oder wechseln Sie auf serumfreie, chemisch definierte Medien
- Testen und quarantänisieren Sie alle neuen Zelllinien vor der Nutzung
- Setzen Sie strikte Biosicherheitsprotokolle für alle Mitarbeitenden um
- Vermeiden Sie den Bezug von Materialien bei nicht verifizierten Anbietern
- Führen Sie Chargenverfolgung und eine lückenlose Dokumentation für alle eingehenden Reagenzien ein
- Schulen Sie das Personal in Bezug auf menschliche Übertragungswege (z. B. respiratorische Viren)
💡 Die langfristigen Risiken verstehen
Viren zeigen sich nicht immer
Im Gegensatz zu anderen Kontaminanten können Viren völlig unbemerkt bleiben – und dennoch Zellen verändern oder sich in ihr Genom integrieren. Manche Infektionen beeinflussen nur empfindliche Analysen wie Transkriptom- oder Proteomanalysen, andere können ganze Produktionsprozesse zum Stillstand bringen.
Die Kosten fehlender Prävention
In GMP-Umgebungen oder der Herstellung wiegt ein viraler Ausbruch besonders schwer: Eine gesamte Produktionscharge kann unbrauchbar werden – mit Verlusten in sechsstelliger Höhe und potenziellen Imageschäden. Prävention muss daher in jeder Phase integriert sein – von der Rohstoffbeschaffung über Mitarbeiterschulung bis hin zur Probenverarbeitung.
Regelmäßige Tests sind teuer – nicht zu testen kostet noch mehr.
Antibiotika in der Zellkultur: Hilfe oder Hindernis?
Auch wenn sie nicht direkt als Kontaminationsquelle gelten, können Antibiotika Ihre Präventionsstrategie beeinträchtigen – und manchmal mehr schaden als nützen.
Antibiotika und Antimykotika werden häufig eingesetzt, um das Risiko mikrobieller Kontamination zu senken – doch in vielen Routinekulturen können sie neue Probleme verursachen, die die Aussagekraft von Experimenten untergraben. Zwar scheint ihre Anwendung zur Vermeidung von Zellkulturkontamination hilfreich, doch in Wirklichkeit erzeugen sie oft ein falsches Sicherheitsgefühl, das versteckten Kontaminanten das Überleben ermöglicht – mit möglichen Auswirkungen auf die Ergebnisse.
❌ Warum Antibiotika problematisch sein können
- Sie verschleiern Kontaminationen, insbesondere langsam wachsende wie Mykoplasmen. Die Kulturen wirken äußerlich gesund, während sich die Infektion unbemerkt ausbreitet – oft bleibt dies unentdeckt, bis die Ergebnisse bereits verfälscht sind.
- Sie fördern resistente Mikrobenstämme über die Zeit. Bakterien und Pilze, die wiederholt subletalen Antibiotikamengen ausgesetzt sind, können Resistenzen entwickeln – was zukünftige Kontaminationen schwerer behandelbar macht und das Risiko einer langanhaltenden Laborverunreinigung erhöht.
- Sie verändern das Zellverhalten, selbst in niedrigen Konzentrationen. Gängige Antibiotika wie Penicillin-Streptomycin beeinflussen Genexpression, Stressantworten und Zellproliferation – was zu verzerrten Daten und eingeschränkter Reproduzierbarkeit führen kann.
(Quelle: Nature-Publikation)
✅ Wann der Einsatz sinnvoll ist – wenn überhaupt
Antibiotika können in kurzfristigen Situationen hilfreich sein – etwa beim Anlegen von Primärkulturen aus Gewebe (mit erhöhtem Kontaminationsrisiko, z. B. Urin) oder beim Versuch, eine seltene oder wertvolle Zelllinie zu retten. In solchen Fällen sollte der Einsatz zeitlich streng begrenzt sein und durch regelmäßige Kontaminationsnachweise (z. B. PCR auf Mykoplasmen) begleitet werden.
Für alle Standardabläufe gilt: Die beste Strategie zur Vermeidung von Zellkulturkontamination ist, gänzlich auf Antibiotika zu verzichten – und stattdessen auf konsequente aseptische Technik, saubere Arbeitsumgebungen und verifizierte, kontaminationsfreie Reagenzien zu setzen.
Fazit: Keine Magie – nur gute Gewohnheiten
Kontaminationen in der Zellkultur zu verhindern, erfordert mehr als nur Vorsicht – es geht darum, kluge Gewohnheiten in den Arbeitsalltag zu integrieren. Die gute Nachricht? Mit den richtigen Werkzeugen und Routinen wird sauberes Arbeiten schnell zur Selbstverständlichkeit.
✅ Die wichtigsten Maßnahmen zur Vermeidung von Zellkulturkontamination
- Regelmäßig testen – insbesondere auf stille Gefahren wie Mykoplasmen
- Sterile, zertifizierte Reagenzien verwenden – keine Kompromisse bei Medium oder Serum
- Konsequent aseptisch arbeiten – Routine schlägt Improvisation
- Brutschränke und Werkbänke reinigen – schnell vergessen, teuer im Schadensfall
- Immer nur eine Zelllinie gleichzeitig bearbeiten – und alles klar beschriften
- Alle Mitarbeitenden schulen – die häufigste Kontaminationsquelle ist der Mensch, nicht das Produkt
Kontamination ruiniert Ihre Experimente?
Ob unzuverlässige Ergebnisse, verlorene Zeit oder mysteriöse Zellkollaps – Kontamination trifft immer dann, wenn man sie am wenigsten braucht.
Deshalb bieten wir getestete, kontaminationsfreie Zellkulturreagenzien und kompetente Beratung, damit Probleme gar nicht erst entstehen.
👉 Kontaktieren Sie uns, um Ihre Kulturen sauber und Ihre Daten zuverlässig zu halten.
Kostenlose Checkliste zum Ausdrucken: So bleiben Ihre Kulturen sauber
Dieses praktische Merkblatt fasst die wichtigsten Tipps aus dem Artikel zusammen – ideal zum Ausdrucken und Aufhängen im Labor als tägliche Erinnerung.
- ✅ Übersicht über tägliche & wöchentliche Routinen auf nur einer Seite
- 🔬 Kontrollfelder zur Dokumentation von Reinigung und Tests
- 📌 Kein E-Mail-Eintrag nötig – einfach herunterladen und verwenden
Hinweis: Die PDF-Checkliste ist auf Englisch.
Häufig gete (FAQs)
Was sind die Hauptquellen für Kontaminationen in der Zellkultur? html Copy Edit


Die häufigsten Quellen sind Bakterien, Pilze, Mykoplasmen, Viren und Kreuzkontaminationen durch andere Zelllinien. Sie gelangen oft durch unzureichende aseptische Technik, unsaubere Geräte oder nicht-sterile Reagenzien in die Kulturen.
Wie kann ich eine Mykoplasma-Kontamination verhindern?


Neue Zelllinien sollten immer zunächst isoliert und getestet werden, bevor sie verwendet werden. Verlassen Sie sich nicht auf Antibiotika, und überprüfen Sie Ihre Kulturen regelmäßig mit PCR- oder ELISA-Kits. Eine saubere, aseptische Arbeitsweise ist Ihr bester Schutz.
Ist der Einsatz von Antibiotika in allen Zellkulturen sicher?


Der Routineeinsatz von Antibiotika wird nicht empfohlen. Zwar können sie das Bakterienwachstum unterdrücken, jedoch auch niedriggradige Kontaminationen verschleiern und resistente Stämme fördern. Besser ist es, die Ursache durch sauberes Arbeiten zu beseitigen.
Wie oft sollte ich den Inkubator und die Sterilwerkbank reinigen?


Werkbänke und Arbeitsflächen sollten mindestens einmal pro Woche abgewischt werden. Inkubatoren müssen wöchentlich gründlich gereinigt werden (Regale, Dichtungen, Wassertabletts). Alle Wartungsmaßnahmen sollten immer in einem gut sichtbaren Protokoll dokumentiert werden.
Warum sollte ich meine Zelllinien authentifizieren?


Die Authentifizierung stellt sicher, dass du mit dem korrekten Zelltyp arbeitest, und beugt Fehlidentifikation oder Kreuzkontamination vor. Die Short Tandem Repeat (STR)-Profilierung ist die gängigste Methode und sollte regelmäßig durchgeführt werden.