Antibiotika in der Zellkultur:
Risiko oder Routine?
Kontamination vermeiden – ohne die Zellintegrität zu gefährden
In vielen Laboren gehören Antibiotika wie Pen-Strep, Gentamicin oder Amphotericin B zur Standardausstattung des Kulturmediums. Sie sollen vor bakterieller oder pilzlicher Verunreinigung schützen – besonders in Gemeinschaftsbrutschränken oder bei Primärzellen.
Doch dieser Schutz ist nicht ohne Preis. Antibiotika können die Genexpression verändern, Infektionen verdecken oder empfindliche Zelllinien schädigen – oft, ohne dass es sofort sichtbar wird.
Ein Screening von über 2.700 Zelllinien zeigte Kontaminationen in fast 40 % der Fälle – davon 19 % mit Mykoplasmen (Uphoff & Drexler, 2005). Kein Wunder also, dass viele Labore auf Nummer sicher gehen wollen.
In diesem Artikel klären wir, wann Antibiotika sinnvoll sind, wann sie mehr schaden als nützen – und wie Sie sie gezielt einsetzen, ohne Ihre Zellkultur zu verfälschen.
Geprüft von Dr. Sabrina Friederichs · Letzte Aktualisierung: 4. August 2025
TL;DR: Zusammenfassung
Sollte man Antibiotika in der Zellkultur verwenden?
Nur 30 Sekunden Zeit? Das sind die wichtigsten Punkte:
|
|
|
|
|
|
|
Best Practices auf einen Blick (Kostenloses PDF)
Laden Sie unser druckfreundliches PDF mit Übersichtstabellen, Anwendungshinweisen und praktischen Empfehlungen herunter – ideal für Ihr nächstes SOP-Update oder Laborschulung.
- ✅ Arbeitskonzentrationen für Pen-Strep, Gentamicin & Amphotericin B
- 📋 Schneller Überblick: Kontaminationsarten & Maßnahmen
- 🧪 Wann Antibiotika sinnvoll sind – und wann nicht
📋 Übersicht: Antibiotikaeinsatz in der Zellkultur
Springen Sie direkt zum gewünschten Abschnitt:
Welche Antibiotika werden in der Zellkultur häufig verwendet?
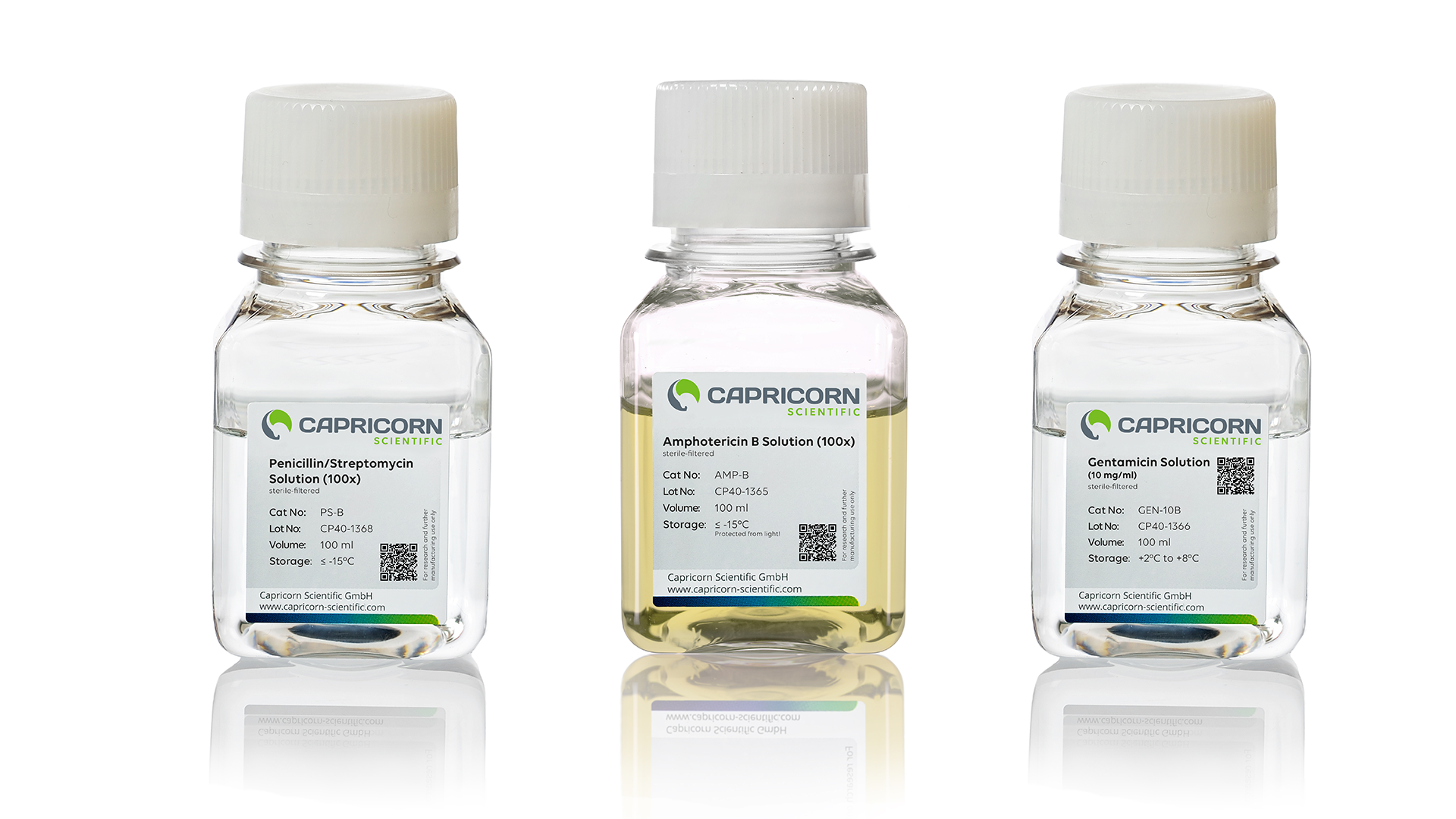
In Zellkulturlaboren begegnet man immer wieder denselben Antibiotika – oft als Standardzusatz zur Minimierung von Kontaminationsrisiken im Routinebetrieb.
🦠 Penicillin-Streptomycin (Pen-Strep)
Eine bewährte Kombination mit breitem Wirkungsspektrum gegen Bakterien. Pen-Strep ist besonders in stark frequentierten Laboren verbreitet, in denen Sterilität schwerer zu kontrollieren ist.
🧫 Gentamicin
Dieses Breitbandantibiotikum ist häufig Bestandteil vorformulierter Antibiotika-Antimykotika-Kombinationen. Es wirkt besonders effektiv gegen gramnegative Bakterien – kann jedoch empfindliche Zelllinien belasten.
🍄 Amphotericin B
Ein Antimykotikum zur Vorbeugung gegen Pilz- oder Hefekontaminationen. Bereits geringe Mengen sind wirksam, höhere Konzentrationen können jedoch Säugerzellen schädigen und erfordern Lichtschutz bei der Handhabung.
Hinweis: Dieser Artikel behandelt Routine-Antibiotika – keine Selektionsmarker
Hier geht es um Antibiotika zur Vermeidung mikrobieller Kontaminationen. Selektionsantibiotika wie G418 oder Hygromycin B – zur Aufrechterhaltung stabiler Transfektanten – sind nicht Thema dieses Beitrags.
Das behandeln wir ein andermal.
Pathogene und empfohlene Antibiotika: Was wirkt und worauf Sie achten sollten
Nicht alle Kontaminanten verhalten sich gleich – und kein Antibiotikum ist gegen jede Bedrohung wirksam. Die folgende Tabelle zeigt typische Zellkultur-Kontaminanten und gängige Ansätze zu deren Bekämpfung.
| Pathogentyp | Empfohlenes Antibiotikum / Kombination | Hinweise zu Wirksamkeit / Zytotoxizität |
|---|---|---|
| Gram-positive Bakterien | Penicillin–Streptomycin (Pen-Strep) | Synergistische Kombination; wirksam gegen die meisten Gram-positiven Bakterien. Geringe Zytotoxizität bei Standardkonzentration (1×). |
| Gram-negative Bakterien | Streptomycin, Gentamicin | Gentamicin deckt ein breiteres Gram-negatives Spektrum ab. Kann empfindliche Zelllinien belasten. |
| Gemischte Bakterienflora | Pen-Strep + Gentamicin | Deckt ein breiteres bakterielles Spektrum ab. Bei Langzeitanwendung auf Resistenzentwicklung achten. |
| Pilzkontamination | Amphotericin B | Wirksames Antimykotikum. Höhere Dosen können Säugerzellen schädigen. Schwer wasserlöslich; meist mit Desoxycholat formuliert, um die Löslichkeit zu erhöhen. Lichtempfindlich – vor Licht schützen. Lagerung bei –20 °C. |
| Gemisch aus Pilzen + Bakterien | Antibiotic-Antimycotic-Lösung (Pen-Strep + Amphotericin B) | Praktische Mischung aus Pen-Strep und Amphotericin B. Für Details zu Anwendung, Zytotoxizität und Lagerung siehe die Einzelkomponenten oben. |
| Mykoplasmen | — (Erfordert gezielte Behandlung) Mehr dazu hier |
Besitzen keine Zellwand – daher gegen gängige Antibiotika unempfindlich. PCR-basierte Nachweisverfahren und mykoplasmenspezifische Eliminationsreagenzien verwenden. |
🧪 Eine Kundin erzählte uns einmal – bei einem späten Telefonat – von ihren frühen Tagen in der Zellkultur. Damals setzten sie Pen-Strep routinemäßig „zur Sicherheit“ ein. Als sie es schließlich für einen Viabilitätstest wegließen, brach die gesamte Kultur innerhalb von 48 Stunden zusammen. Die stille Kontamination war bis dahin völlig unbemerkt geblieben – erst ohne das chemische „Krückstock“ wurde sie sichtbar.
Praxisberichte wie dieser zeigen, warum Antibiotika Probleme oft eher verdecken als lösen.
Auch wenn sie sichtbare Kontaminationen verringern, können sie niedriggradige Probleme verschleiern. Setzen Sie Antibiotika stets in Kombination mit sauberer Technik, regelmäßiger Kontrolle und Sterilitätsprüfungen ein.
Möchten Sie mehr Tipps wie diese direkt in Ihr Postfach?
Melden Sie sich an und erhalten Sie klare, praxisorientierte Updates zu Kontaminationskontrolle, Zellkulturstrategien und laborerprobten Workflows – entwickelt für echte Wissenschaftler:innen, keine Werbung.
Zum Newsletter anmeldenVorteile des Einsatzes von Antibiotika
🧬 "Wir betrachten Antibiotika oft als Sicherheitsnetz – besonders beim Auftauen von Zellen oder bei der Arbeit mit Primärzellen, die anfälliger für Kontaminationen sind."
— QC-Manager:in, Capricorn Scientific
- Kontaminationskontrolle:
Hilft, bakterielles und fungales Überwachsen zu unterdrücken – insbesondere in unvorhersehbaren oder risikoreichen Laborumgebungen.
- Schutz wertvoller Zelllinien:
Wertvolle oder nicht ersetzbare Kulturen profitieren von zusätzlichem Schutz – besonders in gemeinsam genutzten Inkubatoren oder bei hohem Arbeitsaufkommen.
- Unterstützung der Primärzellkultur:
Primärzellen sind in der Anfangsphase anfälliger; Antibiotika können hier vorübergehende Stabilität bieten.
Risiken und Nachteile

Veränderte Genexpression
Pen-Strep beseitigt nicht nur Infektionen – es kann auch das Zellverhalten subtil verändern. In HepG2-Zellen wurden über 200 Gene unterschiedlich exprimiert, wenn sie mit Pen-Strep kultiviert wurden, darunter Gene, die mit Stressreaktionen und Stoffwechselprozessen in Verbindung stehen.
(Quelle: Scientific Reports)
„Antibiotika schützen Ihre Kulturen nicht nur – sie programmieren sie leise um.“
Das klingt dramatisch, ist aber nicht weit von der Wahrheit entfernt.
Zytotoxische Effekte
Hohe Dosen von Gentamicin oder Amphotericin B können die Membranfunktion beeinträchtigen und die Proliferation verlangsamen – insbesondere bei empfindlichen oder stammzellähnlichen Zelltypen. Der Zellzustand sollte daher engmaschig überwacht werden.
(Quelle: Gulhane Med J)
Überdeckte Kontamination
Antibiotika können Probleme eher verbergen als lösen. Anstatt Kontaminationen zu beseitigen, unterdrücken sie diese oft nur – sodass beispielsweise Mykoplasmen unbemerkt bleiben, wenn nicht aktiv getestet wird. Darüber hinaus kann eine Langzeitanwendung das Zellverhalten verändern, wie Studien an Keratinozyten zeigen.
(Quelle: Exp Dermatol. Nygaard et al., 2015)
Entwicklung von Resistenzen
Übermäßiger Einsatz fördert Resistenzen – auch im Labor. In einer Studie waren über 90 % der bakteriellen Isolate aus kontaminierten Kulturen resistent gegen Pen-Strep, was den breiteren klinischen Trend widerspiegelt.
(Quelle: Human Reproduction)
Antibiotic-Antimycotic-Lösungen & ihre Anwendung
Antibiotic-Antimycotic-Mischungen – typischerweise als 100× flüssige Stammlösungen erhältlich – gehören in vielen Laboren zur Standardausstattung. Meist enthalten sie:
- Penicillin (10.000 U/mL)
- Streptomycin (10 mg/mL)
- Amphotericin B (25 µg/mL)
Diese Kombinationen vermitteln ein Gefühl von Sicherheit, besonders in unvorhersehbaren Laborumgebungen – sind jedoch kein Ersatz für konsequente aseptische Technik.
Wie in der obigen Tabelle gezeigt, schützt diese Mischung sowohl vor Gram-positiven als auch Gram-negativen Bakterien sowie vor pilzlichen Kontaminanten. Dennoch ist es wichtig, ihre Grenzen zu kennen.
Mykoplasmen beispielsweise besitzen keine Zellwand – und sind daher von Natur aus gegen die meisten Antibiotika, einschließlich der in Mischformulierungen enthaltenen, resistent.
Stamm- und Arbeitskonzentrationen
| Antibiotikum | Stammlösung (empfohlen) | Arbeitskonzentration | Hinweise | Lösungsmittel & Lagerung |
|---|---|---|---|---|
| Pen-Strep | 100× (10.000 U/mL) | 1× (100 U/mL / 100 µg/mL) | Synergistisch; Standard in den meisten Laboren | Wasserlöslich; bei –20 °C lagern; wiederholtes Einfrieren und Auftauen vermeiden |
| Gentamicin-Sulfat | 50 mg/mL | 10–50 µg/mL | Breitbandantibiotikum; dosisabhängige Zytotoxizität | Wasserlöslich; bei –20 °C lagern; in wässriger Lösung stabil |
| Amphotericin B | 250 µg/mL | 0,25–2,5 µg/mL | Lichtempfindlich; höhere Konzentrationen können die Zellviabilität beeinträchtigen | Schlecht wasserlöslich; typischerweise in kolloidalen Suspensionen mit Deoxycholat formuliert, um die Löslichkeit zu erhöhen. Lichtempfindlich – vor Licht schützen; bei –20 °C lagern |
| Mycoplasma Removal Reagent | — | Gemäß Herstellerangaben | Zielgerichtete Eliminierung; kein Ersatz für routinemäßige Tests. Mehr über Mykoplasmen-Kontamination hier. |
In der Regel tiefgefroren lagern; kann Aliquotierung und lichtgeschützte Handhabung erfordern. Stets den Herstellerangaben folgen. |
Prüfen Sie stets das Datenblatt des Produkts auf Lösungsmittelverträglichkeit und Hinweise zur Haltbarkeit.
Best Practices: Wann einsetzen – wann vermeiden?

| Szenario | Empfohlene Vorgehensweise | Begründung |
|---|---|---|
| Eingefrorene Zellen auftauen | Antibiotika verwenden | Zellen sind während der anfänglichen Regeneration besonders empfindlich. |
| Primärkultur (frühe Passagen) | Antibiotika verwenden | Verringert das Risiko eines frühen Verlusts durch Kontamination. |
| Gemeinsam genutzte Inkubatoren oder beengte Laborsituationen | Antibiotika verwenden (kurzfristig) | Erhöhtes Kontaminationspotenzial. |
| Vermutete Pilz- oder Mischkontamination | Antibiotikum-Antimykotikum-Kombination verwenden | Breite Abdeckung, jedoch nur für den kurzfristigen Einsatz geeignet. |
|
|
||
| Empfindliche Zelltypen (z. B. Stammzellen) | Antibiotika vermeiden | Stärker anfällig für zytotoxische und unspezifische Effekte. |
| Genexpressions-, epigenetische oder Phänotyp-Studien | Antibiotika vermeiden | Diese Substanzen können das Zellverhalten verändern und Ergebnisse verfälschen. |
| Mykoplasmen nicht ausgeschlossen | Antibiotika vermeiden | Kann Symptome unterdrücken – stattdessen gezielte Nachweis- und Behandlungsverfahren einsetzen. |
| Langfristige Erhaltung sauberer Kulturen | Antibiotika vermeiden | Kann aseptische Probleme verschleiern und langfristig Resistenz fördern. |
In antibiotikafreien Kulturen macht sich eine Kontamination schnell bemerkbar — und das ist positiv. Sie müssen wissen, wenn etwas nicht stimmt.
Für einen umfassenderen Überblick über Kontaminationsrisiken jenseits von Antibiotika, siehe unseren Leitfaden zu 5 häufigen Quellen der Zellkulturkontamination und wie man sie vermeidet.
Verwandte Produkte
- Penicillin/Streptomycin (100×) – Breitband-Basisantibiotikum mit Gram-positiver/negativer Abdeckung.
- Antibiotikum/Antimykotikum-Lösung (100×) – Kombiniert Pen-Strep mit Amphotericin B für Pilz- und Bakterienschutz.
- MycoXpert, Mykoplasma-Entfernungsreagenz (50×) – Spezifisches Reagenz zur Eliminierung von Mykoplasmen in der Kultur.
Fazit
Antibiotika sind nicht von Natur aus schlecht oder schädlich — doch ihre standardmäßige und unreflektierte Anwendung schafft langfristig mehr Probleme, als sie löst. Auf Dauer schützen eine solide Technik und regelmäßige Kontaminationskontrollen Ihre Kulturen wirksamer als jede antimikrobielle Mischung.
Verwenden Sie Antibiotika gezielt, nicht aus Gewohnheit — so erhalten Sie sowohl Ihre Zelllinien als auch die Verlässlichkeit Ihrer Daten.
Bereit, Ihre Antibiotika-Strategie zu überdenken?
Laden Sie unser laborfertiges PDF mit Entscheidungstabellen, Checklisten und Arbeitseinstellungen herunter — ideal für Ihr nächstes Experiment oder die Überarbeitung Ihrer SOP.
PDF-Guide herunterladen (EN)Häufig gestellte Fragen (FAQs)
Was ist der Unterschied zwischen Pen-Strep und Gentamicin?


Pen-Strep wirkt synergistisch gegen sowohl grampositive als auch gramnegative Bakterien. Gentamicin hat ein breiteres Wirkungsspektrum, insbesondere gegen gramnegative Stämme, ist jedoch zytotoxischer – vor allem bei empfindlichen Zelltypen.
Kann ich Antibiotika verwenden, um Mykoplasmen zu eliminieren?


Mit Standardantibiotika nicht zuverlässig. Mykoplasmen besitzen keine Zellwand und sind daher von Natur aus resistent gegen die meisten herkömmlichen Wirkstoffe. Spezielle Eliminationsreagenzien – oft auf gezielten Antibiotikakombinationen basierend – können jedoch in Verbindung mit geeigneter Detektion und anschließender Kontrolltestung wirksam sein. Eine PCR-Analyse bleibt unerlässlich, um den Erfolg zu bestätigen.
Mehr über Mykoplasmenkontamination im Knowledge Center erfahren.
Ist Antibiotic-Antimycotic Solution 100× überall gleich?


Die meisten folgen einer ähnlichen Zusammensetzung (Pen-Strep-Amphotericin), aber Konzentrationen und Stabilisatoren variieren je nach Hersteller. Prüfen Sie immer die Produktspezifikationen.
Sollte ich Antibiotika komplett absetzen?


Nicht unbedingt. Viele Labore reduzieren den routinemäßigen Einsatz, behalten Antibiotika jedoch für Risikoschritte wie das Auftauen oder frühe Passagen bei. Entscheidend ist, sie gezielt – nicht automatisch – einzusetzen und stets mit sauberer aseptischer Technik zu kombinieren.
Gibt es Antibiotika, die keinen Einfluss auf die Genexpression haben?


Fast alle Antibiotika können in zelluläre Signalwege eingreifen. Wenn die Genexpression kritisch ist, sollte vollständig auf Antibiotika verzichtet und die Kulturen engmaschig überwacht werden.
Kann ich die Antibiotikakonzentration zur Reduzierung der Zytotoxizität verringern?


Technisch ist es möglich, die Konzentration zu senken – dies sollte jedoch nur vorübergehend und mit äußerster Vorsicht geschehen. Subinhibitorische Dosen können Resistenz fördern und werden für den Routineeinsatz nicht empfohlen.
Wie überprüfe ich am besten auf Kontamination ohne Antibiotika?


Um versteckte Kontaminationen zu erkennen, Zellen unter dem Mikroskop inspizieren, PCR-basierte Mykoplasmatests durchführen oder DAPI-Färbung verwenden – und erwägen, Kulturen für 1–2 Passagen ohne Antibiotika zu führen, um unterdrückte Infektionen aufzudecken.
Verwandte Artikel
Mykoplasmen-Kontamination: Alles, was Sie wissen sollten
Erfahren Sie, wie Mykoplasmen Zellkulturergebnisse stillschweigend verfälschen, wie man sie frühzeitig erkennt und mit MycoXpert wirksam beseitigt.
Erfahren Sie, wie Mykoplasmen Zellkulturergebnisse stillschweigend verfälschen, wie man sie frühzeitig erkennt und mit MycoXpert wirksam beseitigt.
Zellkultur-Kontamination: 5 häufige Quellen und wie Sie sie vermeiden
Lernen Sie, wie Sie bakterielle, virale, pilzliche, Mykoplasmen- und Kreuzkontaminationen frühzeitig erkennen und vermeiden – inklusive Checkliste zum Ausdrucken.
Lernen Sie, wie Sie bakterielle, virale, pilzliche, Mykoplasmen- und Kreuzkontaminationen frühzeitig erkennen und vermeiden – inklusive Checkliste zum Ausdrucken.