
Zytogenetik
Medien & Reagenzien
Die Zytogenetik befasst sich im Wesentlichen mit der Untersuchung der Chromosomen, insbesondere während der Mitose/Meiose. Die Genetik spielt eine entscheidende Rolle bei zellulären Prozessen und somit bei der Entwicklung und weiteren Entstehung von Krankheiten.
Um eine exzellente Patientenversorgung aufrechtzuerhalten, sind zytogenetische Medien und Reagenzien von größter Bedeutung für die Diagnostik. Je nach Fragestellung kann die zytogenetische Diagnostik in pränatale und postnatale Diagnostik unterteilt werden.
PRÄNATAL
Die pränatale Diagnostik konzentriert sich auf die Analyse von z. B. Fruchtwasser (Amniozentese) oder Chorionzottenzellen des Embryos.
POSTNATAL
Die postnatale Diagnostik beschäftigt sich mit der Analyse von z. B. peripheren Blutlymphozyten oder Knochenmarkzellen.
ZYTOGEN. REAGENZIEN
Für die Analyse werden Reagenzien benötigt, z. B. um Zellen während der Mitose in der Metaphase zu arretieren oder die Mitose zu stimulieren.
Quick Links
Füllen Sie unser Musterformular aus und testen Sie unsere Zytogenetik-Produkte!
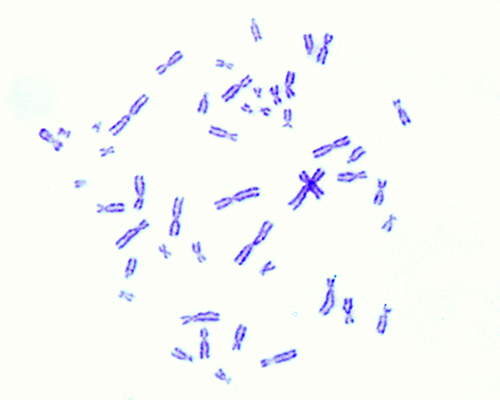
Mit Giemsa gefärbte menschliche Chromosomen (G-Banding)
Was ist Zytogenetik?
Traditionell wurde der Begriff "Zytogenetik" verwendet, um die Untersuchung von Chromosomenanomalien und deren Zusammenhang mit bestimmten Krankheiten zu beschreiben. In den 1960er Jahren entdeckten Wissenschaftler zum Beispiel den Chromosomenfehler, der das Down-Syndrom verursacht. Seitdem wurden zahlreiche Krankheiten mit Chromosomenanomalien in Verbindung gebracht.
Heutzutage könnte dieser Bereich in der Tiefe durch den Begriff "molekulare Zytogenetik" erweitert werden, der neben der klassischen Karyotypisierungs-Methode verschiedene Anwendungen der Molekularbiologie umfasst, beispielsweise die Fluoreszenz-in-situ-Hybridisierung (FISH) oder die vergleichende genomische Hybridisierung (Comparative Genomic Hybridisation, CGH).
Diese Methoden stellen präzisere Instrumente dar, um Bereiche auf dem Chromosom zu identifizieren, die mit einer bestimmten Erkrankung assoziiert werden können. Des Weiteren haben sie sich zu einem wesentlichen Werkzeug in der Krebsdiagnostik entwickelt und bieten die Möglichkeit, herauszufinden, wie ein Patient auf eine spezifische Therapie ansprechen könnte.
Karyotypisierung und chromosomale Anomalien
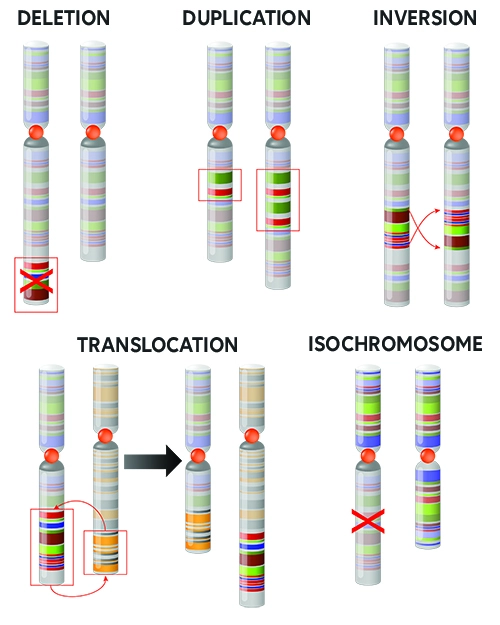
Die Karyotypisierung bezeichnet den Prozess, bei dem alle Chromosomen eines Organismus gepaart und angeordnet werden, wobei das resultierende Bild, das potenzielle Abweichungen erkennen lässt, als Karyogramm bezeichnet wird. Um ein Karyogramm zu erstellen, sind umfangreiche Beobachtungen erforderlich, die Folgendes umfassen:
- Größe und Anordnung der Chromosomen
- Lage der Zentromere
- Verteilung der heterochromatischen Regionen
- andere strukturelle Anomalien
Einige Beispiele für strukturelle Anomalien, wie Deletion, Duplikation oder Inversion sind in der Abbildung rechts veranschaulicht dargestellt.
Die meisten dieser Phänomene haben ihren Ursprung direkt in der Ei- oder Samenzelle und können daher im gesamten Organismus auftreten. In einigen Fällen tritt die Anomalie jedoch erst später in der Entwicklung auf und ist daher nur in einer bestimmten Zelllinie des Körpers zu finden.
Molekulare Zytogenetik
Während in frühen Ansätzen der Zytogenetik den Wissenschaftlern lediglich Techniken wie Färbung und Mikroskopie zur Verfügung standen, umfasst der neuere Begriff der molekularen Zytogenetik zahlreiche molekularbiologische Anwendungen, wie z. B.:
- Fluoreszenz-in-situ-Hybridisierung (FISH)
- Spektrale Karyotypisierung (SKY)
- Mehrfarbige FISH (M-FISH)
- komparative genomische Hybridisierung (Comparative Genomic Hybridisation, CGH)
Im Allgemeinen ermöglichen diese Techniken den Nachweis spezifischer Nukleinsäuresequenzen in morphologisch erhaltenen Chromosomen. Auf diese Weise können sogar Chromosomenanomalien, die kleine DNA-Abschnitte betreffen, aufgedeckt werden.
Die zytogenetische Diagnostik lässt sich in zwei große Bereiche unterteilen: die pränatale und die postnatale Diagnostik. Während sich die pränatale Diagnostik – wie der Name schon sagt – auf Chromosomenanomalien konzentriert, die vor der Geburt zu beobachten sind, findet die postnatale Diagnostik in jedem Alter nach der Geburt ihre Anwendung.
Pränatale Zytogenetik
Pränataldiagnostik wird häufig angewandt, wenn bestimmte Risikofaktoren für eine Schwangerschaft vorliegen, wie z. B. genetische Störungen in der Familie, Schwangerschaft in späteren Jahren (über 35), Bluthochdruck, Diabetes, Asthma, usw. Ziel ist es, Chromosomenanomalien in den frühen Stadien der fötalen Entwicklung festzustellen, um die Möglichkeit eines Schwangerschaftsabbruchs zu bewerten.
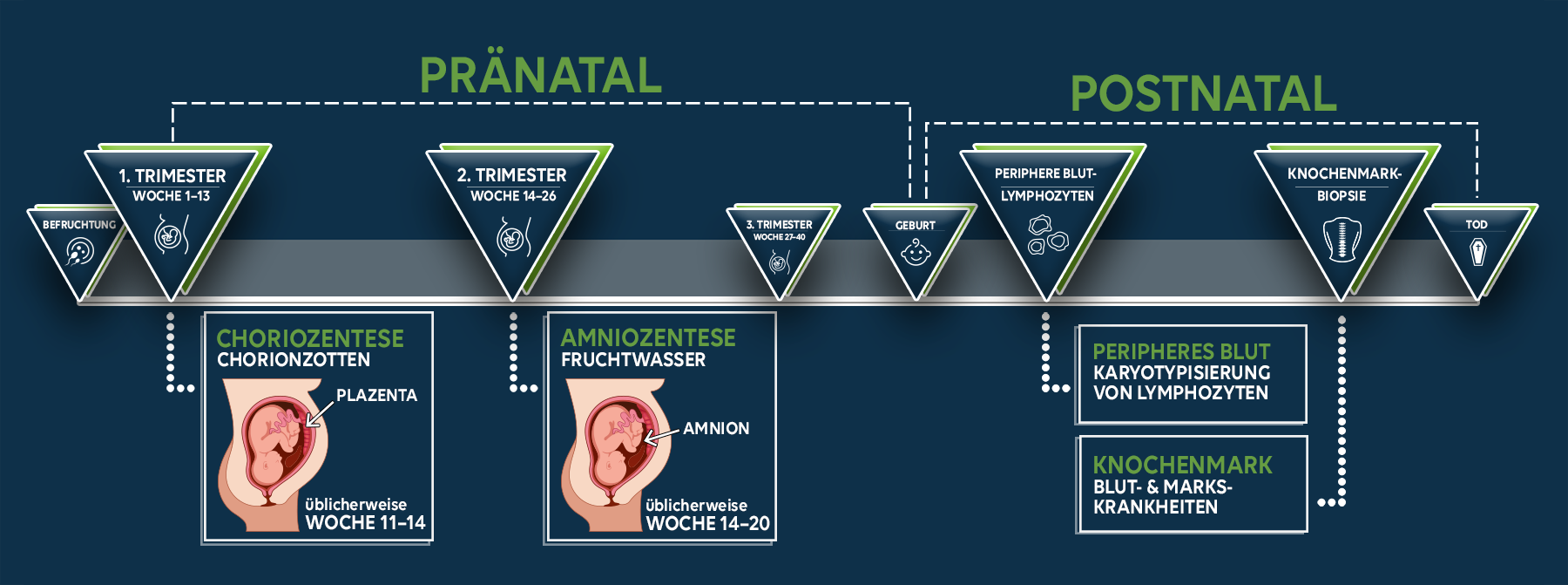
Postnatale Zytogenetik
Die postnatale zytogenetische Diagnostik umfasst zahlreiche Techniken, doch die wichtigsten sind die Analyse der hämatopoetischen Zellen (blutbildende Zellen) und der Lymphozyten des peripheren Blutes.
Hämatopoetische Zellen werden durch eine Knochenmarkpunktion gewonnen, ein in der Hämatologie sehr gängiges Verfahren. Diese Zellen können sich zu beliebigen Blutzelltypen entwickeln. Zusätzlich dient die Untersuchung dazu, den Gesundheitsdienstleistern Erkenntnisse darüber zu liefern, wie eine bestimmte Erkrankung, z. B. Leukämie, zu therapieren ist. So ist beispielsweise ein defektes Gen, das zu einer veränderten Zellfunktion führt, häufig die Ursache für die Tumorentstehung. Die weitere Untersuchung dieses Gens und die Art und Weise, wie die Veränderung zustande kommt, kann nun zur Entdeckung potenzieller Behandlungsmöglichkeiten beitragen.
Die Analyse von Blutlymphozyten ist ein weiteres wichtiges Instrument für die Gewinnung von Informationen über Chromosomenanomalien. Sie liefert nicht nur Daten aus einem anderen Blickwinkel auf die Blutzelllinie, sondern kann auch zeigen, wie genetische Störungen in einer Population verbreitet sind und wie sie mit einem bestimmten Phänotyp zusammenhängen.
Einfach ausgedrückt ist eine Blutprobe leichter zu gewinnen als ein Knochenmark-Präparat und bietet einen zeitsparenden und unkomplizierten Ansatz. Dennoch bleiben Lymphozyten aus dem Knochenmark ein wichtiger Akteur in der Zytogenetik, da bei Lymphozyten aus dem Blut bereits eine Differenzierung in spezifische Zelltypen erfolgt ist.
Unabhängig von der verwendeten Analysemethode umfasst das Verfahren in der Regel folgende Schritte, die zur Erstellung eines fotografischen Bildes der angeordneten Chromosomen, auch bekannt als Karyogramm, führen.
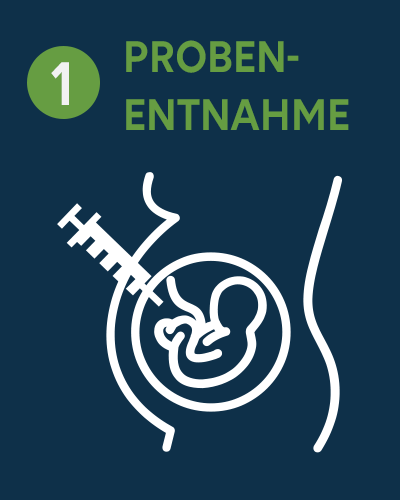
Zunächst wird dem Patienten eine Probe entnommen, z. B. durch Choriozentese, Amniozentese, Blutprobe oder Knochenmarkspunktion.

Anschließend wird die Probe in einer Zellkultur angezüchtet, bis - je nach Anwendung - eine ausreichende Menge an Zellen vorhanden ist.
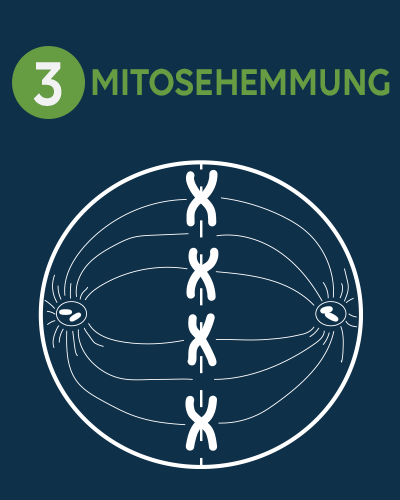
Die kultivierten Zellen werden mit Hilfe eines Mitostatikum, wie Colcemid oder Colchicin, arretiert.
Das Mitostatikum verhindert die Spindelbildung während der Mitose, wodurch die Zellen in der Metaphase arretiert werden.

Die Zellen werden geerntet, mit einer hypotonen Lösung (z. B. Kaliumchlorid) behandelt und gefärbt.
Die Färbung der Zellen kann mit verschiedenen Mitteln erfolgen, z. B. mit Giesma-Farbstoff.

Nach der Färbung sind die Metaphasenchromosomen unter dem Mikroskop deutlich sichtbar.
Zur Identifizierung und Paarung der Chromosomen wird ein Lichtbild aufgenommen und die Chromosomen können neu angeordnet werden.

Das endgültige Bild wird als Karyogramm bezeichnet.
Nach der Analyse kann der Gesundheitsdienstleister nun Chromosomenanomalien bewerten und Empfehlungen für die beste Vorgehensweise geben.
Zytogenetische Medien
Pränatale Diagnostik
Amnionzellen und Chorionzotten
Bei der pränatalen Diagnostik, egal ob Fruchtwasser- oder Chorionzottenuntersuchung, ist die Zeit bis zum Vorliegen eines Ergebnisses von entscheidender Bedeutung. Nicht nur, dass die Eltern oft ängstlich auf die Ergebnisse warten – je nach Ergebnis kann ein Schwangerschaftsabbruch eine Option sein, die in Betracht gezogen werden muss.
Für die Analyse ist eine erhebliche Menge an Metaphasenchromosomen erforderlich. Daher müssen die bei der Probenahme gewonnenen Zellen zunächst kultiviert werden – und zwar so schnell wie möglich. Das von Ihnen gewählte Medium sollte für den Gewebetyp optimiert sein und ein schnelles Zellwachstum unterstützen.
Postnatale Diagnostik

Lymphozyten aus dem peripheren Blut
Für die Routineuntersuchung von Lymphozyten aus peripherem Blut sollten Sie eine optimiertes, zeitsparendes Kultivierungsmedium verwenden, zur Stimulation des Lymphozytenwachstums.
Daher ist die Zugabe von Phytohämagglutinin-M (PHA-M) für die kurzfristige Kultivierung von Lymphozyten unerlässlich. Dies liegt daran, dass Lymphozyten normalerweise keine weiteren Zellteilungen vornehmen – ein Mitogen wie PHA-M ist erforderlich, um die Mitose einzuleiten.
Knochenmarkzellen und leukämische Blutzellen
Auch wenn man Knochenmarkproben direkt auf Chromosomenanomalien untersuchen könnte, ist es notwendig, sie zunächst in einer Zellkultur anzuzüchten. Denn bei einigen Knochenmarkproben zeigt sich die Störung erst nach weiteren Zellteilungen in der Kultur.
Bei der Kultivierung von Knochenmark oder leukämischen Blutproben sind verschiedene hämatopoetische Zellen (myeloische und lymphoide Abstammungslinien) vorhanden. Daher sind, je nach Zelltyp, unterschiedliche Wachstumsstimulanzen erforderlich (weitere Informationen finden Sie in der "Gebrauchsanweisung"). Unabhängig davon sollten die allgemeinen wachstumsfördernden Faktoren für Knochenmarkzellen und leukämische Blutproben in Ihrem Medium vorhanden sein.
Zytogenetische Reagenzien

Phytohämagglutinin-M (PHA-M)
Phytohämagglutinin (PHA) ist ein Mitogen, das verwendet wird, um die Zellproliferation von Lymphozyten und Monozyten anzuregen sowie die Agglutination von Erythrozyten zu bewirken. Es handelt sich dabei um ein Lektin, das in Hülsenfrüchten vorkommt und am häufigsten aus der roten Kidneybohne (Phaseolus vulgaris) gewonnen wird.
PHA besteht eigentlich aus zwei eng verwandten Molekülen: Leukoagglutinin (PHA-L) und Erythroagglutinin (PHA-E), und jedes dieser Moleküle besteht wiederum aus fünf Isolektinen (Tetrameren), die durch nicht-kovalente Kräfte zusammengehalten werden. PHA-M ist die Mukoproteinform und ist ein Rohextrakt – es enthält alle gelösten Stoffe, die aus dem Pflanzenmaterial extrahiert wurden.
Colcemid Lösung(10 µg/ml) in DPBS
Colcemid
Colcemid, auch bekannt als Demecolcin, ist eng mit dem natürlichen Alkaloid Colchicin verwandt, aber weniger toxisch. Es wird häufig in der Zellkultur verwendet, um Zellen in der Metaphase für die Karyotypisierung zu arretieren, insbesondere für die Karyotypisierung von Lymphozyten.
Colcemid übt seine Wirkung aus, indem es die Depolymerisation von Mikrotubuli bewirkt und somit die Bildung von Spindelfasern hemmt. In der Medizin wird es zur Verbesserung von Krebstherapien eingesetzt, indem es Tumorzellen in der Metaphase synchronisiert. Während dieser Phase reagieren die Zellen am empfindlichsten auf die Strahlentherapie, wodurch Colcemid eine bessere Wirksamkeit der Behandlung ermöglicht.
Kaliumchlorid (KCl)
Kaliumchlorid (KCl) wird häufig für verschiedene zytogenetische Anwendungen verwendet, darunter Karyotypisierung, Fluoreszenz-in-situ-Hybridisierung (FISH) und Chromosomenanalyse.
Aufgrund des geringeren osmotischen Drucks von KCl im Vergleich zum Zellplasma kann diese Lösung einen osmotischen Druckunterschied erzeugen, der sie als Lysereagenz geeignet macht. In diesem Prozess bewirkt es, dass die Zellmembranen anschwellen und reißen, wodurch die Chromosomen für die anschließende Analyse offengelegt werden.
Im Allgemeinen erleichtert die Behandlung von Zellen mit KCl ihre Expansion für eine optimale Ausbreitung der Metaphasenchromosomen bei der Karyotypisierung. Nach der Behandlung können die Chromosomen fixiert und mit verschiedenen Farbstoffen angefärbt werden, um die Bandenmuster sichtbar zu machen, so dass Zytogenetiker ihre Struktur analysieren und etwaige Anomalien unter dem Mikroskop erkennen können.
Häufig gestellte Fragen (FAQ)
Kann ich meine Produkte noch verwenden, wenn sie in einem angetauten Zustand ankommen?


Ja! Wir empfehlen einen kontrollierten Auftauprozess bei 4 °C im Kühlschrank. Anschließend müssen Sie durch leichtes Schwenken der Flasche die Lösung homogenisieren. Nun können Sie das Medium aliquotieren und erneut einfrieren. Wichtig: Wenden Sie den kontrollierten Auftauprozess nur an, wenn Sie sicherstellen können, dass Ihr Produkt zu mindestens 50 % (sichtbares Volumen) einen Eiskern enthält – andernfalls raten wir Ihnen vom weiteren Gebrauch ab, da die Performance nicht mehr gewährleistet werden kann.
Wie werden die Medien nach Gebrauch gelagert?


Einmal geöffnet, können die Produkte bei +2 °C bis +8 °C gelagert werden und sollten innerhalb des vorgegebenen Zeitraums verbraucht werden:
- AmnioPrime: 2 Wochen
- MarrowPrime: 2 Wochen
- LymphoPrime und LymphoPrime 2: 10 Tage
- PHA-M: 4 Wochen
- Colcemid: 4 – 6 Wochen
Im ungeöffneten Zustand können Sie die Medien bei -15 °C bis zum Ablauf des Haltbarkeitsdatums lagern.
Muss ich den Medien weitere Supplemente hinzufügen?


Nein, unsere Medien werden gebrauchsfertig (ready-to-use) geliefert und benötigen keine weitere Ergänzung mit Zusätzen.
Auf welchen Bestandteilen basiert ihre Formulierung?


AmnioPrime und MarrowPrime:
Die Formulierung basiert auf einem MEM-Alpha Basalmedium mit Zusatz von Gentamicin, L-Glutamin, Serum, Hormonen und Wachstumsfaktoren.
LymphoPrime und LymphoPrime 2:
Die Formulierung basiert auf einem Basalmedium mit Zusatz von Gentamicin, L-Glutamin, Serum, Antibiotika und PHA-M.
Beinhalten die Medien tierische Substanzen?


Ja, wir fügen unseren Medien vorselektiertes fötales Kälberserum (FBS) hinzu.
Welches Medium eignet sich am besten für chromosomale Analysen?


- MarrowPrime:
unterstützt die Zellanlagerung und das Zellwachstum von Knochenmark- und leukämischen Blutzellen. - LymphoPrime:
ist bestens geeignet für die Kurzzeitkultivierung von Lymphozyten aus dem peripheren Blut. - AmnioPrime:
wurde speziell für die Kultivierung von humanen primären Amnion- und Chorionzottenzellen entwickelt, die für die Erstellung von Karyogrammen, Fluoreszenz-in-situ-Hybridisierung und andere zytogenetische Methoden bestimmt sind. AmnioPrime gewährleistet optimale Wachstumsbedingungen für Amniozyten (Fruchtwasserzellen) und Chorionzottenzellen (Mutterkuchen).
Mein PHA-M erscheint trüb. Kann ich das Produkt weiter nutzen?


PHA-M kann bei +2 °C bis +8 °C trüb erscheinen. Die Trübung hat keinen Einfluss auf die Aktivität von PHA-M.
Was ist der Unterschied zwischen Colchicin und Colcemid?


N-Deacetyl-N-methycolchicin (Colcemid) und Colchicin sind miteinander verwandte Alkaloide. Sie werden unter anderem für die Mitosehemmung verwendet, indem sie die Ausbildung der Spindelfasern durch Bindung an freie Rezeptoren unterdrücken. Der wesentliche Unterschied zwischen beiden Produkten besteht darin, dass Colcemid weniger toxische Eigenschaften, verglichen mit Colchicin, aufweist.
Mein Colcemid zeigt eine Präzipitatbildung. Kann dies Auswirkungen auf meine Analysen haben?


Sobald eine Präzipitatbildung zu erkennen ist, empfehlen wir das Produkt nicht weiter zu verwenden.
Wie viel PHA-M muss ich hinzufügen, um eine Konzentration von 10 µg/ml zu erhalten?


Nach dem Auftauen enthält jeder Milliliter jeweils 5 bis 10 mg Protein. Wir empfehlen den Einsatz von 2 bis 4 ml PHA-M auf 100 ml Ihres Karyotypisierungsmediums.
Meine Medien zeigen eine Farbveränderung, kann ich mein Produkt weiterverwenden?


Häufig wird eine Farbveränderung des Mediums mit einem pH-Shift in Verbindung gebracht. Während der Produktion werden die Medien auf ihre spezifischen pH-Werte eingestellt. Durch den Transport auf Trockeneis oder einer länger zeitigen Lagerung kann es zu einer Abweichung des ursprünglichen pH-Wertes kommen. In diesem Fall empfehlen wir die Inkubation der betroffenen Flaschen mit leicht geöffnetem Schraubverschluss. Hierfür drehen Sie den Deckel etwas an (ca. ¼ Umdrehung) und inkubieren die Flasche für ca. 1 Stunde bei 37 °C und 5 % CO2 in einem Zellkulturinkubator. Somit kann sich der pH-Wert erneut einstellen.
Meine Medien zeigen einen unterschiedlichen Farbverlauf im gefrorenen Zustand. Kann ich die Medien weiterverwenden?


Erst im aufgetauten Zustand kann eine endgültige Aussage über die Qualität des Mediums getroffen werden. Wir empfehlen Ihnen, die Medien mithilfe eines kontrollierten Auftauprozesses (4 °C im Kühlschrank) aufzutauen und diese anschließend zu schwenken. Häufig verliert sich der scheinbare Farbunterschied und das Produkt zeigt seine typische Farbe.
Sind Ihre Produkte auch für den therapeutischen Gebrauch geeignet?


Nein, unsere Produkte sind lediglich für die Anwendung in der Forschung und für in-vitro-Diagnostik geeignet. Unsere Produkte sind nicht für therapeutische Verfahren an Menschen und Tier zugelassen.
Welche Mengen an Material werden für die Testung benötigt?


- Fruchtwasserzellen nach Amniozentese: 10 – 15 ml Fruchtwasser
- Chorionzottenzellen nach Chorionzottenbiopsie (CSV): 15 – 20 mg Chorionzottengewebe
- Postnatale Chromosomenanalyse an Lymphozyten: 2 – 10 ml Vollblut
- Postnatale Chromosomenanalyse an Gewebeproben: 1 cm² Hautbiopsie, Nabelschnur
Gebrauchsanweisungen
In situ Kultivierung von Amnionzellen


- Zentrifugieren Sie 20 ml Fruchtwasser bei 750 U/min für 10 Minuten.
- Dekantieren Sie das überschüssige Fruchtwasser vom Zellpellet vorsichtig in ein steriles Reagenzglas.
- Resuspendieren Sie das Zellpellet mit 2 ml Fruchtwasser. Fügen Sie 2 ml AmnioPrime-Medium hinzu und schwenken dies vorsichtig.
- Kultivieren Sie 0,5 ml der Zellsuspension auf einem Deckglas in einer Gewebekulturschale.
- Die Kulturen werden bei +37 °C und 5 % CO₂ inkubiert
- An Tag 2 erfolgt ein Mediumwechsel mit 2 ml AmnioPrime. Empfehlung: Mediumwechsel alle 2 Tage.
- An Tag 4 und 5 erfolgt eine Wachstumskontrolle der Zellen sowie ein Mediumwechsel. Saugen Sie das Kulturmedium vorsichtig ab und ersetzten es durch 2 ml frisches AmnioPrime.
- Ist ein konfluentes Wachstum zu erkennen, können die Zellen geerntet werden.
Die besten Ergebnisse erzielen Sie, wenn Sie das Medium am Tag vor der Zellernte wechseln.
Kultur von Amnionzellen in Zellkulturflaschen


Nutzen Sie das Protokoll der in situ Kultivierung, mit folgenden Anpassungen:
- Resuspendieren Sie die Zellen in 4 ml Fruchtwasser.
- Fügen Sie 16 ml AmnioPrime hinzu und schwenken das Gefäß vorsichtig.
- Säen Sie 5 ml Zellen pro T25 Zellkulturflasche aus
- Inkubation bei +37 °C und 5 % CO₂
- Nach 5 Tagen erfolgt die Wachstumskontrolle
Die besten Ergebnisse erzielen Sie, wenn Sie das Medium am Tag vor der Zellernte wechseln.
Empfehlungen für geschlossene Systeme:
Methode 1: Ergänzen Sie AmnioPrime-Medium mit 2 % (v/v) steriler 1 M HEPES-Lösung. Die
HEPES-Lösung muss auf pH 7,0 bei +20 °C eingestellt werden. HEPES-ergänztes Medium kann anschließend für Zellen in geschlossenen Kulturflaschen verwendet werden.
Methode 2: Die Zellkulturflasche mit dem AmnioPrime-Medium und den Zellen bei +37 °C und 5 % CO 1 Stunde lang äquilibrieren, bevor die Flasche geschlossen wird.
Methode 3: Jede Zellkulturflasche, die AmnioPrime und Zellen enthält, 20 Sekunden lang mit 5 % CO₂/95 % Luft durch einen 0,2 µm Sterilfilter filtrieren. Anschließend die Flaschen fest zugedreht bei +37 °C inkubieren.
Protokoll für das Ernten von Knochenmarkzellen


- Röhrchen für 5 Minuten bei 1500 U/min zentrifugieren
- Resuspendieren Sie das Pellet in 6 ml vorgewärmter hypotonischer Kaliumchlorid-Lösung (KCl, 0,075 M) und inkubieren Sie diese für 20 Minuten bei +37 °C im Wasserbad.
- Zentrifugieren Sie die Röhrchen für 5 Minuten bei 1500 U/min.
- Dekantieren Sie den Überstand.
- Fügen Sie 5 ml Fixiermittel (3 Methanol: 1 Essigsäure) in das Röhrchen. Geben Sie langsam einige Tropfen des Fixiermittels hinzu und mischen Sie dabei vorsichtig. Geben Sie auf diese Weise so lange Fixiermittel hinzu, bis sich alle Zellklumpen aufgelöst haben und die Zellsuspension so homogen wie möglich ist.
- Zentrifugieren Sie die Röhrchen für 5 Minuten bei 1500 U/min.
- Wiederholen Sie Schritt 6 – 7 zweimal.
- Nach dem letzten Waschschritt den Überstand vorsichtig entfernen, ohne das Pellet zu beschädigen. Das Pellet in einer für die Objektträgerpräparation geeigneten Menge Fixiermittel resuspendieren.
Kultur von Amnionzellen in Zellkulturflaschen


Nutzen Sie das Protokoll der in situ Kultivierung, mit folgenden Anpassungen:
- Resuspendieren Sie die Zellen in 4 ml Fruchtwasser.
- Fügen Sie 16 ml AmnioPrime hinzu und schwenken das Gefäß vorsichtig.
- Säen Sie 5 ml Zellen pro T25 Zellkulturflasche aus
- Inkubation bei +37 °C und 5 % CO₂
- Nach 5 Tagen erfolgt die Wachstumskontrolle
Die besten Ergebnisse erzielen Sie, wenn Sie das Medium am Tag vor der Zellernte wechseln.
Empfehlungen für geschlossene Systeme:
Methode 1: Ergänzen Sie AmnioPrime-Medium mit 2 % (v/v) steriler 1 M HEPES-Lösung. Die
HEPES-Lösung muss auf pH 7,0 bei +20 °C eingestellt werden. HEPES-ergänztes Medium kann anschließend für Zellen in geschlossenen Kulturflaschen verwendet werden.
Methode 2: Die Zellkulturflasche mit dem AmnioPrime-Medium und den Zellen bei +37 °C und 5 % CO₂ 1 Stunde lang äquilibrieren, bevor die Flasche geschlossen wird.
Methode 3: Jede Zellkulturflasche, die AmnioPrime und Zellen enthält, 20 Sekunden lang mit 5 % CO₂/95 % Luft durch einen 0,2 µm Sterilfilter filtrieren. Anschließend die Flaschen fest zugedreht bei +37 °C inkubieren.
So bereiten Sie eine hypotone Lösung (0,075 M KCl) für die Karyotypisierung vor


Dieses Protokoll zeigt Ihnen, wie Sie 1 Liter 0,075 M KCl-Lösung herstellen.
- Einweigen von 5,6 g KCl
- Mit destilliertem Wasser auf 1000 ml auffüllen.
Bitte beachten Sie: Die hypotonische Lösung sollte vor der Verwendung auf 37 °C erwärmt werden.
Protokoll für das Ernten von Knochenmarkzellen


- Röhrchen für 5 Minuten bei 1500 U/min zentrifugieren
- Resuspendieren Sie das Pellet in 6 ml vorgewärmter hypotonischer Kaliumchlorid-Lösung (KCl, 0,075 M) und inkubieren Sie diese für 20 Minuten bei +37 °C im Wasserbad.
- Zentrifugieren Sie die Röhrchen für 5 Minuten bei 1500 U/min.
- Dekantieren Sie den Überstand.
- Fügen Sie 5 ml Fixiermittel (3 Methanol: 1 Essigsäure) in das Röhrchen. Geben Sie langsam einige Tropfen des Fixiermittels hinzu und mischen Sie dabei vorsichtig. Geben Sie auf diese Weise so lange Fixiermittel hinzu, bis sich alle Zellklumpen aufgelöst haben und die Zellsuspension so homogen wie möglich ist.
- Zentrifugieren Sie die Röhrchen für 5 Minuten bei 1500 U/min.
- Wiederholen Sie Schritt 6 – 7 zweimal.
- Nach dem letzten Waschschritt den Überstand vorsichtig entfernen, ohne das Pellet zu beschädigen. Das Pellet in einer für die Objektträgerpräparation geeigneten Menge Fixiermittel resuspendieren.
Protokoll für den Aufbau und die Kultivierung von Knochenmarkzellen


- Wenn eine Knochenmarkprobe in Transportmedium vorliegt, zentrifugieren Sie diese für 10 Minuten bei 150 bis 170 × g. Enthält Ihr Untersuchungsmaterial Heparin, starten Sie mit Schritt 3.
- Entfernen Sie vorsichtig den Überstand, einschließlich des auf der Oberfläche schwimmenden Fetts und der Zelltrümmer und verwerfen diese.
- Geben Sie 5 ml MarrowPrime in jedes Röhrchen.
- Mit sterilen Pasteurpipetten die entsprechende Menge an Knochenmarkzellen einfüllen. Die Endkonzentration der Zellen sollte 106 Zellen/ml pro Kultur betragen.
- Die Kulturen entsprechend der vorläufigen Diagnose anlegen:
Direktkultur: 100 µl Colcemid-Lösung (10 µg/ml) für 1 bis 2 Stunden hinzufügen. Kurzzeit-Kultur: Über Nacht inkubieren. Am nächsten Morgen 100 µl Colcemid-Lösung (10 µg/ml) für 1 bis 2 Stunden zugeben. Einwirkung von Colcemid über Nacht: Möglichst spät am Tag 50 µl (10 µg/ml) Colcemid-Lösung zugeben. Über Nacht bei +37 °C inkubieren. Kurzzeit-Kultur + Colcemid über Nacht: 24, 48 oder 72 Stunden bei +37 °C inkubieren. Dann so spät wie möglich 50 µl (10 µg/ml) Colcemid-Lösung zugeben. Über Nacht bei +37 °C inkubieren. B-Zell-stimulierte Kulturen: 100 µl PMA (4-Phorbol 12-Myristat 13-Acetat) und/oder PWM (Pokeweed Mitogen) zugeben und 2 bis 4 Tage bei +37 °C inkubieren. 100 µl Colcemid-Lösung (10 µg/ml) zugeben und über Nacht bei +37 °C inkubieren. T-Zell-stimulierte Kulturen: 100 µl PHA (Phytohämagglutinin) hinzufügen und 72 Stunden bei +37 °C inkubieren. 100 µl Colcemid-Lösung (10 µg/ml) für 1 bis 2 Stunden zugeben.
LymphoPrime & LymphoPrime 2: Kultur von Lymphozyten aus peripherem Blut für die Chromosomenanalyse


- LymphoPrime auftauen und Aliquots von 10 ml herstellen (sterile Röhrchen).
- Übertragen Sie 0,5 ml heparinisiertes Vollblut in ein Röhrchen mit 10 ml LymphoPrime.
- Die Kultur bei +37 °C und 5 % CO₂ im Brutschrank 72 Stunden lang inkubieren.
- Geben Sie 0,1 – 0,2 ml Colcemid-Lösung (Kat-Nr. COL-H) in jedes Kulturröhrchen (Endkonzentration von 0,1 µg/ml). Inkubieren Sie die Kultur für weitere 15 – 30 Minuten.
- Überführen Sie die Kultur in ein Zentrifugenröhrchen und zentrifugieren dieses bei 500 × g für 5 Minuten.
- Den Überstand abnehmen und die Zellen in 5 – 10 ml vorgewärmter (+37 °C), hypotonischer 0,075 M KCl-Lösung resuspendieren.
- Inkubation der Zellen bei +37 °C für 10 – 12 Minuten.
- Zentrifugation für 5 Minuten bei 500 × g.
- Den Überstand abnehmen, das Zellsediment resuspendieren und tropfenweise 5 – 10 ml frisches, eiskaltes Fixiermittel aus 1 Teil Essigsäure auf 3 Teile Methanol zugeben. Bei +4 °C für 10 Minuten stehen lassen.
- Wiederholen Sie die Schritte 9 und 10.
- Zentrifugation für 5 min bei 500 × g.
- Resuspendieren Sie das Zellpellet in einem kleinen Volumen (0,5 – 1 ml) frischen Fixiermittels, tropfen Sie es auf einen sauberen Objektträger und lassen Sie es an der Luft trocknen.
- In diesem Stadium kann das Präparat mit Giemsa gefärbt werden. Für die Giemsa-Färbung können Sie eines der gängigen Färbeprotokolle oder das in Ihrem Labor erstellte Protokoll verwenden.
Verwendung von PHA-M ohne AmnioPrime: Kultur von Lymphozyten aus peripherem Blut für die Chromosomenanalyse


- 2 – 4 ml PHA-M pro 100 ml Karyotypisierungsmedium zugeben.
- Übertragen Sie 0,5 ml heparinisiertes Vollblut in ein Röhrchen mit 10 ml Karyotypisierungsmedium, das mit PHA-M ergänzt wurde (oder 106 lebensfähige Zellen pro ml).
- Die Kultur 72 Stunden lang bei +37 °C und 5 % CO₂ in einem Brutschrank inkubieren.
- 0,1 – 0,2 ml Colcemid-Lösung (Kat-Nr. COL-H) in jedes Kulturröhrchen geben (in einer Endkonzentration von 0,1 µg/ml). Die Kultur für weitere 15 – 30 Minuten inkubieren.
- Überführen Sie die Kultur in ein Zentrifugenröhrchen und zentrifugieren dieses für 5 min bei 500 × g.
- Den Überstand abnehmen und die Zellen in 5 – 10 ml vorgewärmter (+ 37 °C), hypotonischer 0,075 M KCl-Lösung resuspendieren. Inkubation für 10 – 12 min bei +37 °C.
- Zentrifugation für 5 Minuten bei 500 × g.
- Den Überstand abnehmen, das Zellsediment resuspendieren und tropfenweise 5 – 10 ml frisches, eiskaltes Fixiermittel aus 1 Teil Essigsäure auf 3 Teile Methanol zugeben. Für 10 Minuten bei +4 °C stehen lassen.
- Wiederholen Sie die Schritte 7 und 8.
- Zentrifugation für 5 min bei 500 × g.